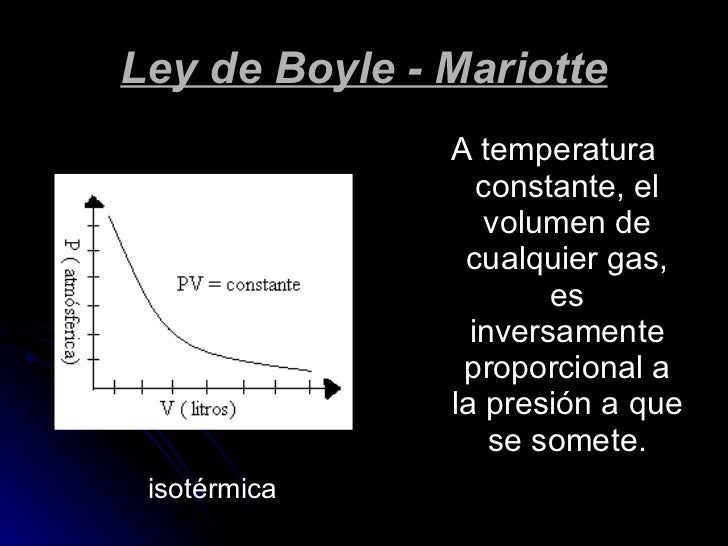
La presión ejercida por una fuerza física es inversamente proporcional al volumen de una masa gaseosa, siempre y cuando su temperatura se mantenga constante
LEY DE AVOGADRO
Relación entre la cantidad de gas y su volumen
Esta ley, descubierta por Avogadro a principios del siglo XIX, establece la relación entre la cantidad de gas y su volumen cuando se mantienen constantes la temperatura y la presión. Recuerda que la cantidad de gas la medimos en moles
el volumen es directamente proporcional a la cantidad de gas
si aumentamos la cantidad de gas , aumentara el volumen
si disminuimos la cantidad de gas , el volumen disminuye .
La ley de Avogadro dice que: Volúmenes iguales de distintas sustancias gaseosas, medidos en las mismas condiciones de presión y temperatura, contienen el mismo número de moléculas.
¿Por qué ocurre esto?
Vamos a suponer que aumentamos la cantidad de gas. Esto quiere decir que al haber mayor número de moléculas aumentará la frecuencia de los choques con las paredes del recipiente lo que implica (por un instante) que la presión dentro del recipiente es mayor que la exterior y esto provoca que el émbolo se desplace hacia arriba inmediatamente. Al haber ahora mayor distancia entre las paredes (es decir, mayor volumen del recipiente) el número de choques de las moléculas contra las paredes disminuye y la presión vuelve a su valor original.
Según hemos visto en la animación anterior, también podemos expresar la ley de Avogadro así: